Saxagliptina
COMPRIMIDOS REVESTIDOS
Apresentações da Onglyza
ONGLYZA está disponível em embalagens contendo: 2,5 mg de saxagliptina: 28 comprimidos revestidos5 mg de saxagliptina: 14 e 28 comprimidos revestidos
USO ORAL
USO ADULTO
Composição da Onglyza
Cada comprimido revestido de ONGLYZA 2,5 mg contém 2,79 mg de cloridrato de saxagliptina (anidra) equivalente a 2,5 mg de saxagliptina. Excipientes q.s.p. .................................................................................................1 comprimido
Excipientes: lactose monoidratada, celulose microcristalina, croscarmelose sódica, estearato de magnésio, álcool polivinílico, polietilenoglicol, dióxido de titânio, talco e óxidos de ferro.
Cada comprimido revestido de ONGLYZA de 5 mg contém 5,58 mg de cloridrato de saxagliptina (anidra) equivalente a 5 mg de saxagliptina.
Excipientes q.s.p. .................................................................................................1 comprimido
Excipientes: lactose monoidratada, celulose microcristalina, croscarmelose sódica, estearato de magnésio, álcool polivinílico, polietilenoglicol, dióxido de titânio, talco e óxidos de ferro.
Informações ao Paciente da Onglyza
1- Como este medicamento funciona?ONGLYZA é um medicamento de uso sob prescrição médica que pertence a uma classe de agentes inibidores de uma enzima de controle da liberação de glicose para o sangue durante a digestão: a dipeptidil peptidase 4 (DPP-4). ONGLYZA melhora o controle de açúcar no sangue de pacientes adultos com diabetes tipo 2 quando utilizado em associação com dieta e exercício. ONGLYZA pode ser utilizado sozinho ou combinado com outros medicamentos que também controlem o açúcar no sangue. ONGLYZA:
• Reduz as concentrações de açúcar no sangue quando as mesmas estão altas, especialmente após as refeições. ONGLYZA também reduz as concentrações de açúcar no sangue entre as refeições;
• Promove o aumento de secreção de insulina pelo organismo após as refeições;
• Modera a produção de açúcar pelo fígado após as refeições. É improvável que ONGLYZA diminua a concentração de açúcar a um nível perigoso, ao ponto de causar hipoglicemia, uma vez que não tem ação quando o nível de açúcar no sangue está baixo.
2- Por que este medicamento foi indicado?
Monoterapia e Terapia combinada:
ONGLYZA é indicado para melhorar o controle de açúcar no sangue de pacientes adultos com diabetes tipo 2 quando utilizado em associação com dieta e exercício.
ONGLYZA não deve ser utilizado para o tratamento de pacientes com diabetes tipo 1 ou para o tratamento da cetoacidose diabética (condição mais grave, em que há nível elevado e perigoso de certos ácidos, conhecidos como cetonas, no sangue ou urina).
3- Quando não devo usar este medicamento?
ONGLYZA não deve ser utilizado para tratamento de:
• Pessoas com diabetes tipo 1;
• Pessoas com histórico ou risco de cetoacidose diabética (condição mais grave, em que há nível elevado e perigoso de certos ácidos, conhecidos como cetonas, no sangue ou urina);
• Pessoas que tiveram reação alérgica (hipersensibilidade) grave a ONGLYZA ou outro medicamento semelhante, usado para controlar os níveis de açúcar no sangue.
Contraindicações da Onglyza
ONGLYZA é contraindicado para pacientes com reações alérgicas a qualquer um dos seus componentes. ONGLYZA não deve ser usado por pessoas que tiveram reação alérgica (hipersensibilidade) grave a ONGLYZA ou outro medicamento semelhante, usado para controlar os níveis de açúcar no sangue. Os sintomas de reação alérgica grave podem incluir:
• Erupções cutâneas (irritação na pele);
• Aumento de manchas vermelhas na pele (urticária);
• Inchaço na face, lábios, língua, e garganta, podendo causar dificuldade em respirar ou engolir.
Precauções e Advertências da Onglyza
Em períodos de estresse corporal, como febre, trauma, infecção ou cirurgia entre em contato com seu médico para que o mesmo o oriente sobre a conduta medicamentosa adequada. Havendo quaisquer dos sintomas de reação alérgica grave descritos anteriormente (vide “Contraindicações”), você deve suspender o tratamento com ONGLYZA e contatar seu médico imediatamente.Uso em pacientes com deficiência nos rins
Para pacientes com deficiência moderada ou grave nos rins ou com deficiência nos rins em estágio terminal e que realizam hemodiálise é necessário adequar a dose única diária deste medicamento, para isso é recomendado que seja realizado um exame para avaliar a função dos rins antes e durante o tratamento com ONGLYZA.
Gravidez e Lactação
Informe ao seu médico se você está grávida, ou pretende engravidar. Não se sabe se o uso de ONGLYZA afeta o desenvolvimento do bebê. Se você está grávida converse com o seu médico sobre a melhor maneira de controlar o açúcar no sangue enquanto estiver grávida.
Se você estiver amamentando ou planeja amamentar, informe ao seu médico, pois ONGLYZA pode passar para o bebê através do leite. Converse com o seu médico sobre a melhor maneira de alimentar seu bebê, caso esteja fazendo uso de ONGLYZA.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Informe imediatamente seu médico em caso de suspeita de gravidez.
Informe o seu médico caso esteja amamentando.
Uso Pediátrico
A segurança e a eficácia de ONGLYZA em pacientes pediátricos não foram estabelecidas.
Uso em idosos
Pacientes idosos normalmente apresentam diminuição na função dos rins, portanto deve-se ter cuidado na seleção da dose em pacientes idosos baseados na função dos rins.
Efeitos na capacidade de dirigir e operar máquinas
Não foi realizado nenhum estudo para verificar a capacidade de dirigir e de operar máquinas.
Entretanto, deve-se levar em conta que pode ocorrer tontura com o uso de ONGLYZA.
Interações Medicamentosas
Informe ao seu médico se estiver fazendo uso de algum outro medicamento, incluindo medicamentos isentos de prescrição, vitaminas, fitoterápicos, suplementos; mantenha uma lista para mostrar ao seu médico ou a outro profissional de saúde.
ONGLYZA pode afetar a forma como outros medicamentos agem, e outros medicamentos podem afetar a ação de ONGLYZA. Contate o médico se você for iniciar ou parar alguns certos tipos de medicamentos, como antibióticos, ou medicamentos que tratam fungos ou HIV/AIDS, pois a sua dose de ONGLYZA talvez precise ser alterada.
Achados Laboratoriais
Ocorreu uma diminuição na contagem de linfócitos (células brancas, diretamente ligadas com o sistema de defesa do corpo humano). A diminuição da quantidade de linfócitos não foi associada com outros problemas importantes. A relevância clínica dessa diminuição na contagem de dessas células brancas em relação ao placebo é desconhecida.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento de seu médico. Pode ser perigoso para sua saúde.
4- Como devo usar este medicamento?
O comprimido revestido de ONGLYZA 5 mg é rosa, biconvexo e arredondado.
O comprimido revestido de ONGLYZA 2,5 mg é amarelo a amarelo claro, biconvexo e arredondado.
Este medicamento não deve ser partido ou mastigado. Você deve ingerir os comprimidos sem mastigar com auxílio de um pouco de líquido. Os comprimidos podem ser ingeridos com ou sem alimentação.
Depois de aberto, ONGLYZA deve ser mantido em sua embalagem original, conservado em temperatura ambiente.
Posologia da Onglyza
Monoterapia e terapia combinada
A dose recomendada de ONGLYZA é de 2,5 mg e 5 mg em dose única diária como monoterapia ou em terapia combinada com outros medicamentos que também diminuam o açúcar no sangue. ONGLYZA pode ser tomado com ou sem alimentos. Deficiência nos rins
Para pacientes com deficiência leve nos rins não é necessário ajuste posológico para ONGLYZA.
Para pacientes com deficiência moderada ou grave nos rins ou com deficiência em estágio terminal nos rins e que realizam hemodiálise a dose de ONGLYZA é de 2,5 mg em dose única diária. ONGLYZA deve ser administrado logo após a hemodiálise.
ONGLYZA não foi estudado em pacientes submetidos à diálise peritoneal.
Deficiência no fígado
Não é necessário ajuste de dose de ONGLYZA para pacientes com deficiência no fígado seja essa deficiência leve, moderada ou grave.
Pacientes pediátricos
Não foram conduzidos estudos de eficácia e segurança com ONGLYZA em pacientes pediátricos.
Pacientes idosos
Não é necessário ajuste de dose para ONGLYZA baseados na idade. Pacientes idosos, normalmente, apresentam diminuição na função dos rins, portanto deve-se ter cuidado na seleção da dose em pacientes idosos baseados na função dos rins.
Fortes inibidores da enzima CYP3A4/5
A dose recomendada de ONGLYZA é de 2,5 mg em dose única diária quando co-administrada com fortes inibidores do citocromo P450 3A4/5 (CYP3A4/5) (por exemplo, cetoconazol, atazanavir, claritromicina, indinavir, itraconazol, nefazodona, nelfinavir, ritonavir, saquinavir e telitromicina).
Conduta necessária caso haja esquecimento de administração de uma dose
Caso você esqueça de tomar os comprimidos de saxagliptina, tome assim que se lembrar. Se você lembrar de tomar a dose esquecida apenas perto do horário da proxima dose, tome apenas a dose seguinte, no horário habitual. Nunca devem ser administradas duas doses ao mesmo tempo, a não ser se o seu médico orientar você a fazer isso. Converse com o médico caso você tenha alguma dúvida a respeito da dose esquecida.
Você deve seguir a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Você não deve interromper o tratamento sem o conhecimento de seu médico.
Não use o medicamento com o prazo de validade vencido. Antes de usar observe o aspecto do medicamento.
5- Quais os males este medicamento pode causar?
Os efeitos adversos mais comuns com o uso de ONGLYZA incluem:
- Infecção do trato respiratório superior
- Infecção do trato urinário
- Dor de cabeça
Diminuição de açúcar no sangue (hipoglicemia) pode agravar-se em pessoas que estejam fazendo outro tratamento para diabetes, tais como uso de sulfoniluréias. Informe seu médico se estiver tomando outros medicamentos para diabetes. Se você tiver sintomas de baixo açúcar no sangue, você deve verificar o seu nível de açúcar no sangue e se estiver baixo procurar tratamento entrando em contato com o seu médico. Os sintomas de hipoglicemia incluem: agitação, sudorese, batimento cardíaco rápido, mudança na visão, fome, dor de cabeça, mudança no humor.
Inchaço ou retenção de líquidos nas mãos, pés ou tornozelos (edema periférico) pode agravar- se em pessoas que também estiverem fazendo uso de tiazolidinediona para tratar a diabetes.
Se você não souber se faz uso deste tipo de medicação, pergunte ao seu médico.
As reações alérgicas (de hipersensibilidade), tais como erupções cutâneas, urticária e inchaço da face, lábios e garganta podem ocorrer. Se tiver estes sintomas, pare de tomar ONGLYZA e contate seu médico imediatamente.
Informe ao seu médico sobre a ocorrência de qualquer efeito indesejado persistente. Para maiores informações entre em contato com o médico.
Informe ao seu médico ou cirurgião-dentista o aparecimento de reações indesejáveis.
Atenção: este é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis para comercialização, efeitos indesejáveis e não conhecidos podem ocorrer. Neste caso, informe ao seu médico.
6- O que fazer se alguém usar uma grande quantidade deste medicamento de uma só vez?
Se você acredita que ingeriu uma quantidade muito grande de ONGLYZA entre em contato com seu médico ou Centro de Toxicologia mais próximo.
7- Onde e como devo guardar este medicamento?
ONGLYZA deve ser mantido em sua embalagem original, conservado em temperatura ambiente (15º - 30ºC).
Todo medicamento deve ser mantido em sua embalagem original até o momento do uso.
Todo medicamento deve ser mantido fora do alcance das crianças.
Informações Técnicas Aos Profissionais de Saúde da Onglyza
Características Farmacológicas da Onglyza
ONGLYZA (saxagliptina) é um inibidor ativo por via oral da enzima dipeptidil peptidase 4 (DPP-4). A saxagliptina monoidratada é descrita quimicamente como: (1S,3S,5S)-2-[(2S)-2-amino-2-(3-hidroxitriciclo [3.3.1.13,7] dec-1-il) acetil1]-2-azabiciclo [3.1.0] hexano-3-carbonitrila monohidratada ou (1S,3S,5S)-2-[(2S)-2-amino-2-(3-hidroxi-1-adamantan-1-il)acetil]-2-azabiciclo [3.1.0] hexano-3-carbonitrila hidratada. A fórmula empírica é C18H25N3O2•H2O e o peso molecular é 333,43. A fórmula estrutural é:
- MECANISMO DE AÇÃO:
Concentrações aumentadas dos hormônios incretina como os peptídeos-1 semelhantes ao glucagon (GLP-1) e os e o polipeptídeos insulinotrópicos dependentes de glicose (GIP) são liberados pelo intestino na corrente sanguínea em resposta a uma refeição. Esses hormônios causam a liberação de insulina das células pancreáticas beta de modo glicose-dependente, mas são inativados pelas enzimas DPP-4 dentro de minutos. Além disso, o GLP-1 também diminui a secreção de glucagon pelas células pancreáticas alfa reduzindo a produção hepática de glicose. Em pacientes com diabetes tipo 2, as concentrações de GLP-1 são reduzidas, mas a resposta da insulina ao GLP-1 é preservada. A saxagliptina é um competitivo inibidor da DPP4 que diminui a inativação dos hormônios incretina, aumentando suas concentrações na circulação sanguínea e reduzindo as concentrações de glicose em jejum e pós-prandial de modo glicose-dependente em pacientes com diabetes mellitus tipo II.
Farmacodinâmica da Onglyza
Geral
Nos pacientes com diabetes do tipo 2, a administração de ONGLYZA levou a inibição da atividade da enzima DPP4 durante um período de 24 horas. Após uma carga oral de glicose ou uma refeição, esta inibição da DDP4 resultou em um aumento de 2 a 3 vezes os níveis de circulação dos ativos GLP1 e GIP, diminuiu as concentrações de glucagon e aumentou a secreção de insulina glicose-dependente das células pancreáticas beta. O aumento da insulina e a diminuição do glucagon foram associados a uma menor concentração de glicose em jejum e reduziram a excursão da glicose na sequência de uma carga oral de glicose ou uma refeição. O tratamento com saxagliptina 5 mg e metformina de liberação prolongada administrados uma vez ao dia com a refeição da noite por 4 semanas promoveu reduções significativas na concentração média de glicose durante o intervalo de 24 horas (definido como área sob a curva de glicose ao longo de 24 horas dividido por 24 horas), quando comparado com o placebo + metformina de liberação prolongada (redução média corrigida por placebo de -16,8 mg/dL, p = 0,0001), com melhorias consistentes nos valores de glicemia medidos ao longo do intervalo posológico de 24 horas (Figuras 1 e 2). Reduções significativas na glicose pós-prandial de 2 horas e média de glicemia de jejum de 2 dias foram observadas (redução média corrigida por placebo de -35,4 mg/dL, p = 0,0010 e – 15,3 mg/dL, p = 0,0002, respectivamente).


Eletrofisiologia cardíaca
Em um ensaio randomizado, duplo=cego, placebo controlado, cruzado de 4 braços, com comparador de ativo usando movifloxacino em 40 indivíduos saudáveis ONGLYZA não foi associado com prolongamento clinicamente significativo do intervalo QTc ou frequência cardíaca em doses de até 40 mg (8 vezes a máxima dose recomendada para humanos – MDRH).
Farmacocinética da Onglyza
A farmacocinética da saxagliptina e de seu metabólito ativo, 5-hidroxi saxagliptina, foram similares em indivíduos saudáveis e em pacientes com diabetes mellitus tipo 2. Os valores de Cmax e AUC da saxagliptina e de seu metabólito ativo aumentaram proporcionalmente no intervalo de dose de 2,5 mg a 400 mg. Após uma dose oral única de 5 mg de saxagliptina em indivíduos saudáveis, os valores de AUC plasmático médio para a saxagliptina e o seu metabólito ativo foram 78 ng.h/mL e 214 ng.h/mL, respectivamente. Os valores plasmáticos correspondentes de Cmax foram 24 ng/mL e 47 ng/mL, respectivamente. A variação média (CV%) para a AUC e Cmax para ambos, saxagliptina e seu metabólito ativo, foi inferior a 25%. Nenhum acúmulo apreciável foi observado da saxagliptina e de seu metabólito ativo com repetidas doses únicas diárias em qualquer nível de dose. Nenhuma dependência de dose e de tempo foi observada na depuração da saxagliptina e de seu metabólito ativo durante 14 dias administrando doses diárias de saxagliptina que variaram entre 2,5 mg e 400 mg.Absorção
O tempo médio para a concentração máxima (Tmax) após a administração de uma dose de 5 mg uma vez ao dia foi de 2 horas para saxagliptina e 4 horas para o seu metabolito ativo. A administração com uma refeição rica em gorduras resultou em um aumento de Tmax da saxagliptina por aproximadamente 20 minutos em relação ao jejum. Houve um aumento de 27% na AUC da saxagliptina quando administrada com uma refeição, em comparação com condições de jejum. ONGLYZA pode ser administrado com ou sem alimentos.
Distribuição
A ligação às protéinas plasmáticas in vitro da saxagliptina e do seu metabólito ativo no soro humano está abaixo dos níveis mensuráveis. Por isso, não é esperado que se altere a disposição da saxagliptina com mudanças nos níveis de proteínas sanguíneas em vários estados da doença (por exemplo, insuficiência renal ou hepática).
Metabolismo
O metabolismo da saxagliptina é mediado, principalmente, pelo citocromo P450 3A4/5 (CYP3A4/5). O metabólito ativo da saxagliptina também é inibidor da DPP4, que tem a metade da potênciada saxagliptina. Portanto, fortes inibidores e indutores da CYP3A4/5 alterarão a farmacocinética da saxagliptina e de seu metabólito ativo.
Excreção
A saxagliptina é eliminada por ambas as vias: renal e hepática. Após uma dose única de 50 mg de 14C-saxagliptina, 24%, 36% e 75% da dose de saxagliptina foi excretada na urina, e seu metabólito ativo, e radioatividade total, respectivamente. A média da depuração renal da saxagliptina (~230 mL/min) foi maior do que a taxa média estimada de filtração glomerular (~120 mL/min), sugerindo alguma excreção renal ativa. Um total de 22% da radioatividade administrada foi recuperada nas fezes que representam a fração da dose da saxagliptina excretada na bile e/ou do fármaco não absorvido no trato gastrointestinal. Após uma dose oral única de ONGLYZA 5 mg a indivíduos saudáveis, a meia-vida plasmática média terminal (t1/2) para saxagliptina e seu metabólito ativo foi de 2,5 e 3,1 horas, respectivamente.
Populações especiais
Insuficiência Renal
Em um estudo de dose única, de caráter aberto foi conduzido para avaliar a farmacocinética da saxagliptina (10 mg/dose) em indivíduos portadores de vários níveis de insuficiência renal crônica (N=8 por grupo) comparados com indivíduos com função renal normal. O estudo incluiu pacientes com insuficiência renal classificada conforme o clearance de creatinina: leve (>50 a ≤80 mL/min), moderado (30 a ≤50 mL/min), e grave (<30 mL/min), assim como pacientes com insuficiência renal terminal em hemodiálise. O clearance de creatinina foi estimado da creatinina sérica baseada na fórmula Cockcroft-Gault:
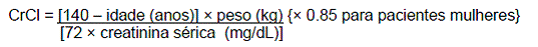
Insuficiência hepática
Em indivíduos com insuficiência hepática (classificados por Child-Pugh em classes A, B e C), os valores médios de Cmax e AUC de saxagliptina foram de até 8% a 77% maiores, respectivamente, quando comparados a controles sadios após administração única de 10 mg de saxagliptina. Os valores de Cmax e AUC correspondentes de seu metabólito ativo foram de 59% a 33% menores, respectivamente, quando comparados ao grupo controle de voluntários sadios. Essas diferenças não foram consideradas clinicamente significativas. Não é necessário realizar ajuste de dose em pacientes com insuficiência hepática.
Índice de massa corporal
Nenhum ajuste de dose é recomendado baseado no índice de massa corporal (IMC). IMC não foi identificado como variável significativa no clearance aparente da saxagliptina ou do seu metabólito ativo em uma análise farmacocinética populacional.
Idosos
Não há recomendação de ajuste de dose baseado apenas na idade. Indivíduos idosos (65 – 80 anos) obtiveram valores geométricos 23% e 59% maiores de Cmax e AUC médias, respectivamente, para saxagliptina do que em indivíduos jovens (18-40 anos). As diferenças observadas na farmacocinética do metabólito ativo da saxagliptina entre indivíduos idosos e jovens normalmente refletiu as diferenças ocorridas na farmacocinética da saxagliptina. A diferença entre a farmacocinética da saxagliptina e de seu metabólito ativo em indivíduos jovens e idosos provavelmente acontece graças a fatores múltiplos incluindo declínio na função renal e na capacidade metabólica conforme aumenta a idade. A idade não foi identificada como uma variante significativa no clearance aparente da saxagliptina ou do seu metabólito ativo em uma análise farmacocinética populacional.
Pediatria
Estudos caracterizando a farmacocinética de saxagliptina em pacientes pediátricos não foram realizados.
Sexo
Não há recomendação de ajuste de dose baseado no sexo do paciente. Não foi observada diferença significativa na farmacocinética da saxagliptina entre homens e mulheres.
Comparadas aos homens, as mulheres obtiveram valores de exposição 25% maiores ao metabólito ativo da saxagliptina do que os homens, mas é improvável que essa diferença possua relevância clínica. O sexo do paciente não foi identificado como uma variante significativa no clearance da saxagliptina ou do seu metabólito ativo em uma análise farmacocinética populacional.
Raça e etnicidade
Não há recomendação de ajuste de dose baseado na raça do paciente. Em uma análise de modelo experimental comparou-se a farmacocinética da saxagliptina e de seu metabólito ativo em 309 indivíduos brancos e 105 indivíduos de outra raça que não a branca (consistindo em um grupo de 6 raças). Não foi observada diferença significativa na farmacocinética da saxagliptina entre as duas populações.
Carcinogênese, Mutagênese e Problemas de Fertilidade da Onglyza
A saxagliptina não induziu tumores em camundongos (50, 250 e 600 mg/kg) ou ratos (25, 75, 150 e 300 mg/kg) nas doses mais altas avaliadas. As doses mais altas avaliadas em camundongos foram equivalentes a aproximadamente 870 (machos) e 1165 (fêmeas) vezes a exposição em humanos na dose humana recomendada de 5 mg/dia. Em ratos, as exposições foram aproximadamente 355 (machos) e 2217 (fêmeas) vezes a dose máxima recomendada para humanos. A saxagliptina não demonstrou-se clastogênica ou mutagênica com ou sem ativação metabólica em um ensaio bacterial Ames in vitro, um ensaio citogenético in vitro em linfócitos humanos primários, um ensaio oral in vivo em micronúcleos em ratos, um estudo in vivo oral de reparo de DNA em ratos, e um estudo oral in vivo/in vitro citogenético em linfócitos de sangue periférico de ratos. A saxagliptina não foi mutagênica ou clastogênica baseado nestes estudos combinados. O principal metabólito não foi mutagênico em um ensaio in vitro de bacterial de Ames.
Em estudos de fertilidade em ratos, os machos foram tratados com doses orais de alimentação forçada por 2 semanas antes do acasalamento, durante o acasalamento e até o término agendado (aproximadamente o total de quatro semanas) e as fêmeas foram tratadas com doses orais de alimentação forçada para 2 semanas antes do acasalamento pelo 7º dia da gestação. Nenhum efeito adverso na fertilidade foi observado à exposição de aproximadamente 603 (machos) e 776 (fêmeas) vezes a dose recomendada para humanos. A uma dose de toxicidade materna mais alta, obervou-se reabsorção fetal aumentada (aproximadamente 2069 e 6138 vezes a dose máxima recomendada para humanos). Efeitos adicionais no ciclo relacionados à fertilidade, ovulação, e implantação foram observados em aproximadamente 6138 vezes a dose máxima recomendada para humanos.
Toxicologia Animal da Onglyza
A saxagliptina produziu alterações na pele (escara e ou ulceração) nas extremidades (unha, dedos, escroto e/ou nariz). As lesões cutâneas foram reversíveis com doses ≥ 20 vezes a dose máxima recomendada para humanos, mas em alguns casos eram irreversíveis e necrosantes com exposições a altas doses. Alterações cutâneas adversas não foram observadas em exposições semelhantes (1 a 3 vezes) à dose máxima recomendada para humanos (5 mg). Correlações clínicas a lesões de pele em macacos não foram observadas em estudos clínicos com a saxagliptina em humanos.Resultados de Eficácia da Onglyza
ONGLYZA foi estudado como monoterapia e em combinação com metformina, glibenclamida e as tiazolidinedionas: pioglitazona e rosiglitazona. Um total de 4148 pacientes com diabetes do tipo 2 foram randomizados, em seis estudos duplo-cego conduzidos para avaliar a segurança e a eficácia glicêmica de ONGLYZA. Um total de 3021 indivíduos desses estudos foi tratado com ONGLYZA. Nestes estudos, a média de idade dos pacientes foi de 54 anos, e 71% dos pacientes eram brancos, 16% eram asiáticos, 4% eram negros, e 9% eram de outros grupos raciais. Um adicional de 423 pacientes, incluindo 315 que receberam ONGLYZA, participaram de um estudo placebo controlado, variando a dose de 6 a 12 semanas de duração.
Nestes seis estudos duplo-cego, ONGLYZA foi avaliado em doses de 2,5 mg e 5 mg uma vez por dia. Em três desses estudos também foi avaliada a dose única de 10 mg ao dia. A dose diária de 10 mg de saxagliptina não forneceu maior eficácia do que a dose diária de 5 mg. O tratamento com ONGLYZA produziu em todas as doses clinicamente relevantes melhorias estatisticamente significativas na hemoglobina A1c (A1C), na glicemia de jejum do plasma (FPG), e na glicemia pós-prandial (PPG), 2 horas PPG que seguem o teste de tolerância glicemia oral (OGTT), comparadas ao grupo controle.
Reduções em A1C foram observadas através dos subgrupos que incluíram o gênero, a idade, a raça e o índice de massa corporal (IMC) inicial.
ONGLYZA não está associado a grandes alterações no peso ou índice de lipídeos no plasma no jejum quando comparados ao placebo.
ONGLYZA foi avaliado em dois estudos adicionais em pacientes com diabetes: um estudo ativo-controlado comparando terapia com ONGLYZA adjuvante à glipizida em 858 pacientes inadequadamente controlados com metformina isolada, e um estudo placebo-controlado comparando ONGLYZA a placebo em 170 pacientes com diabetes tipo 2 e insuficiência renal moderada ou grave, ou doença renal em estágio terminal (ESRD).
Monoterapia
Um total de 766 pacientes virgens de tratamento do diabetes tipo 2 inadequadamente controlados com dieta e exercícios (A1C ≥7% a ≤10%) participaram de dois estudos duplocego, controlados com placebo de 24 semanas de duração para avaliar a eficácia e a segurança da monoterapia com ONGLYZA.
No primeiro estudo, depois de um estudo único-cego de 2 semanas, de dieta, exercício e um período inicial com placebo, os 401 pacientes foram randomizados para os grupos de ONGLYZA 2,5 mg, 5 mg ou 10 mg ou placebo. Os pacientes que não conseguiram cumprir metas glicêmicas específicas durante o estudo foram tratados com a terapia de resgate com metformina, adicionada ao grupo placebo ou ao grupo ONGLYZA. A eficácia foi avaliada na última medição antes da terapia de resgate para os pacientes que precisaram desta. A titulação de dose de ONGLYZA não foi permitida neste estudo.
O tratamento com ONGLYZA 2,5 mg e 5 mg por dia, proporcionou melhorias significativas na A1C, FPG, e PPG em comparação com o placebo (Tabela 1). A proporção de pacientes que descontinuaram o tratamento por falta de controle glicêmico ou que receberam terapia de resgate para obter a glicemia pré-especificada foi 16% no grupo ONGLYZA 2,5 mg, 20% no grupo ONGLYZA, 5 mg e 26% no grupo placebo.

O tratamento com ONGLYZA 5 mg a cada manhã ou 5 mg a cada noite forneceu melhorias significativas em A1C contra o placebo (redução média placebo-corrigida de - 0.4% e -0.3%, respectivamente). O tratamento com ONGLYZA 2,5 mg a cada manhã também forneceu melhorias significativas em A1C contra o placebo (redução média placebo-corrigida de - 0.4%).
Terapia em combinação
Terapia combinada em adição a metformina
Um total de 743 pacientes com diabetes tipo 2 participaram de estudo randomizado, duplocego, placebo-controlado, de duração de 24 semanas, para avaliar a eficácia e segurança de ONGLYZA em combinação com metformina em pacientes com controle glicêmico inadequado (A1C ≥7% e ≤10%) com metformina sozinha. Foi exigido que os pacientes estivessem utilizando uma dose estável de metformina (1500 mg para 2550 mg diariamente) durante, pelo menos, 8 semanas, para então serem adicionados a este estudo.
Pacientes que obedeceram aos critérios de elegibilidade foram incluídos em um período únicocego, de duas-semanas, com dieta e exercício, e início com placebo durante o qual os pacientes receberam metformina na dose de pré-estudo deles, até 2500 mg diariamente. Após o período inicial, os pacientes elegíveis foram randomizados a 2,5 mg, 5 mg, ou 10 mg de ONGLYZA ou placebo, em adição à dose atual de metformina aberta. Pacientes que não obtiveram a glicemia desejada durante o estudo foram tratados com pioglitazona como terapia de resgate, adicionadasàs medições do estudo. Titulações de dose de ONGLYZA e de metformina não foram permitidas neste estudo.
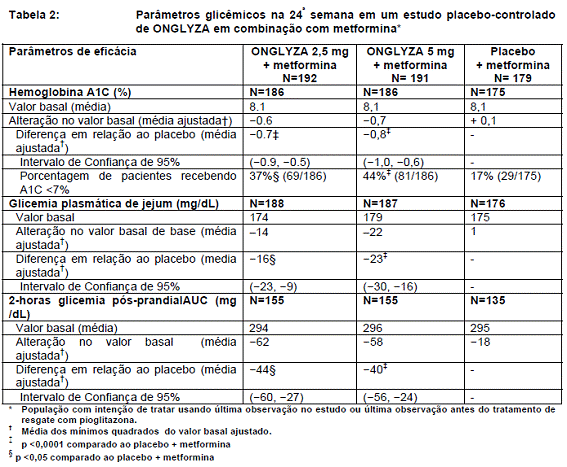
Em combinação com a metformina, ONGLYZA 2,5 mg e 5 mg promoveu melhoras significativas em A1C, FPG, e PPG comparados com o grupo placebo mais metformina (Tabela 2). Alterações médias desde o início para A1C ao longo do tempo e na avaliação são mostrados na Figura 1. A proporção de pacientes que interromperam o tratamento por falta de controle glicêmico, ou que foram resgatadas para atender os critérios glicêmicos pré-especificados foi de 15% para a dose de ONGLYZA 2,5 mg adicionada à metformina, 13% para o grupo de ONGLYZA 5 mg adicionada à metformina, e 27% no grupo placebo adicionada à metformina.

Pacientes que obedeceram aos critérios de elegibilidade foram incluídos em um período únicocego, de duas-semanas, com dieta e exercício e início com placebo, durante o qual os pacientes receberam TZD na dose de pré-estudo deles. Após o período inicial, os pacientes elegíveis foram randomizados a 2,5 mg, 5 mg de ONGLYZA ou placebo, em adição à dose atual de TZD. Pacientes que não obtiveram a glicemia desejada durante o estudo foram tratados com metformina como terapia de resgate, adicionados ao placebo ou ONGLYZA mais TZD. Titulações de dose de ONGLYZA e de TZD não foram permitidas neste estudo. Uma mudança no regime terapêutico de TZD de rosiglitazona para pioglitazona com doses terapêuticas equivalentes e especificadas foram permitidas à discrição do investigador caso o mesmo acreditasse ser clinicamente apropriado.
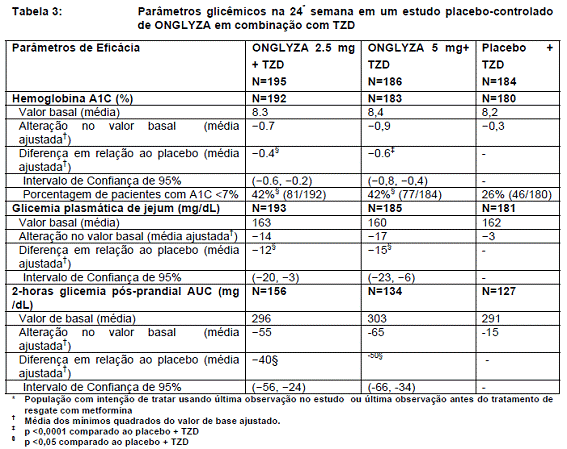
Em combinação com TZD, ONGLYZA 2,5 mg e 5 mg promoveu melhorias significativas em A1C, FPG, e PPG comparados com o grupo placebo mais TZD (Tabela 3). A proporção de pacientes que descontinuaram por falta de controle glicêmico ou que receberam tratamento de resgate para atingir os critérios de glicemia pré-especificados foi de 10% para o grupo de ONGLYZA 2,5 mg mais TZD, 6% para o grupo de ONGLYZA 5 mg mais TZD e de 10% para o grupo placebo mais TZD.
Um total de 768 pacientes com diabetes tipo 2 participaram deste estudo randomizado, duplocego, placebo-controlado de duração de 24 semanas, para avaliar a eficácia e segurança de ONGLYZA em combinação com uma sulfoniluréia (SU) em pacientes com controle glicêmico inadequado (A1C ≥7,5% a ≤10%) com a dose submáxima de SU sozinha. Foi exigido que os pacientes estivessem fazendo uso de uma dose de SU por dois meses ou mais para, então serem incluídos neste estudo. Neste estudo, uma combinação em dose fixa de ONGLYZA e uma dose intermediária de SU foi comparada à titulação com uma maior dose de SU.
Pacientes que obedeceram aos critérios de elegibilidade foram incluídos em um período únicocego, de quatro-semanas, de dieta e exercício, e início com placebo durante o qual os pacientes receberam glibenclamida 7,5 mg uma vez ao dia. Após o período inicial, os pacientes elegíveis com A1C ≥7% a ≤10% foram randomizados a 2,5 mg ou 5 mg de ONGLYZA mais 7,5 mg de glibenclamida ou placebo mais 10 mg de dose total diária de glibenclamida. Pacientes que receberam placebo foram elegíveispara receberem glibenclamida em titulação de aumento de dose até uma dose diária total de 15 mg. Titulações de aumento de glibenclamida não foram permitidas para pacientes que receberam ONGLYZA 2,5 mg ou 5 mg. A diminuição de dose de glibenclamida foi permitida em qualquer grupo de tratamento durante o período de 24 semanas do estudo caso houvesse hipoglicemia, conforme julgado pelo investigador. Aproximadamente 92% dos pacientes do grupo placebo mais glibenclamida tiveram a dose titulada para uma dose total diária de 15 mg durante as primeiras 4 semanas do período de estudo. Pacientes que não obtiveram as metas de glicemia específicas foram tratados com metformina de resgate, e adicionados à medicação do estudo já em andamento. A titulação de dose de ONGLYZA não foi permitida durante o estudo.
Em combinação com a glibenclamida, ONGLYZA 2,5 mg e 5 mg promoveram melhorias significativas em A1C, FPG, e PPG comparados com o grupo placebo mais glibenclamida titulada (Tabela 4). A proporção de pacientes que descontinuaram por falta de controle glicêmico ou que receberam tratamento de resgate para atingir os critérios de glicemia pré-especificados foi de 18% no grupo de ONGLYZA 2,5 mg mais glibenclamida , 17% no grupo de ONGLYZA 5 mg mais glibenclamida e 30% no grupo placebo mais glibenclamida.

Um total de 1306 pacientes virgens de tratamento com diabetes tipo 2 participaram deste estudo randomizado, duplo-cego, ativo-controlado de duração de 24 semanas, para avaliar a eficácia e segurança de ONGLYZA em combinação com metformina para o tratamento inicial de pacientes com controle glicêmico inadequado (A1C ≥8% a ≤12%) com dieta e exercício apenas. Foi exigido que os pacientes fossem virgens de tratamento prévio para, então serem incluídos neste estudo.
Pacientes que obedeceram aos critérios de elegibilidade foram incluídos em um período únicocego, de uma semana, com dieta e exercício e início com placebo. Os pacientes foram randomizados um dos quatro braços de tratamento: ONGLYZA 5 mg + metformina 500 mg, saxagliptina 10 mg + metformina 500 mg, saxagliptina 10 mg + placebo ou metformina 500 mg + placebo. ONGLYZA foi administrado uma vez ao dia. Nos 3 grupos de tratamento usando metformina, a metformina foi titulada em aumentos de dose, incrementos de 500 mg por dia até alcançar uma dose máxima tolerável de 2000 mg por dia, baseado no FPG. Pacientes que não obtiveram as metas de glicemia específicas foram tratados com pioglitazona de resgate como terapia adicional.
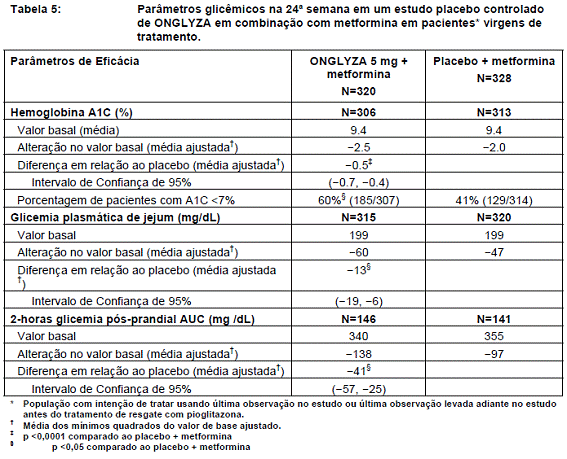
A coadministração de ONGLYZA 5 mg em combinação com a metformina promoveu melhorias significativas em A1C, FPG, e PPG comparados com o grupo de placebo mais metformina (Tabela 5).
Terapia combinada em adição a metformina versus terapia combinada em adição de glipizida a metformina
Neste estudo ativo-controlado de 52 semanas, um total de 858 pacientes com diabetes tipo 2 e controle glicêmico inadequado (A1C>6,5% e ≤10%) com metformina isolada foram ramdomizados em terapia duplo-cega combinada com ONGLYZA ou glipizida. Pacientes foram requeridos a estar sob uso de dose estável de metformina (pelo menos 1500 mg ao dia) por pelo menos 8 semanas anteriores à inscrição.
Os pacientes que cumpriam o critério de elegibilidade foram submetidos a um período introdutório de 2 semanas, simples-cego, com placebo, dieta e exercício, durante o qual os pacientes receberam metformina (1500-3000 mg com base em suas doses pré-estudo). Após o período introdutório, os pacientes eleitos foram randomizados para 5 mg de ONGLYZA ou 5 mg de glipizida em adição à suas atuais doses abertas de metformina. Pacientes no grupo de glipizida com metformina receberam titulação cega da dose de glipizida durante as primeiras 18 semanas do estudo até uma dose máxima de glipizida de 20 mg/dia. A titulação objetivou a meta de FPG < 110mg/mL ou a maior dose tolerada de glipizida. Cinquenta por cento (50%) dos pacientes tratados com glipizida foram titulados até a dose de 20 mg/dia; 21% dos pacientes tratados com glipizida tiveram uma dose final de glipizida de 5 mg ou menos. A dose média diária final de glipizida foi 15 mg.
Após 52 semanas de tratamento, ONGLYZA e glipizida resultaram em reduções médias semelhantes do valor basal de A1C quando adicionada à terapia com metformina (Tabela 6). Esta conclusão pode se limitar a pacientes com valores basais de A1C comparáveis aos do estudo (91% dos pacientes tinham valores basais de A1C < 9%).
De um peso corporal inicial médio de 89 kg, houve uma redução média estatisticamente significativa de 1,1 kg em pacientes tratados com ONGLYZA comparado a um ganho de peso médio de 1,1 kg em pacientes tratados com glipizida (p <0,0001).

Insuficiência Renal
Um total de 170 pacientes participaram de um estudo de 12 semanas, randomizado, duplocego, controlado por placebo conduzido para avaliar a eficácia e segurança de ONGLYZA 2,5 mg uma vez ao dia em comparação com placebo em pacientes com diabetes tipo 2 e insuficiência renal moderada (n=90) ou grave (n=41), ou doença renal em estágio terminal (n=39). Neste estudo, 98% dos pacientes estavam em uso de medicamentos antidiabéticos de fundo (75% faziam uso de insulina e 31% faziam uso de medicamentos antidiabéticos orais, a maioria sulfoniluréias).
Após 12 semanas de tratamento, ONGLYZA 2,5 mg aumentou significativamente a A1C comparado ao placebo (Tabela 7). No subgrupo de pacientes com doença renal em estágio terminal (ESRD), ONGLYZA e placebo resultaram em reduções comparáveis em A1C dos valores basais na semana 12. Este resultado é inconclusivo, pois o estudo não foi devidamente desenhado para demonstrar a eficácia em subgrupos específicos de insuficiência renal.
Após 12 semanas de tratamento, a alteração média na glicose plasmática de jejum (FPG) foi de -12 mg/dL com ONGLYZA 2,5 mg e -13 mg/dL com placebo. Comparado com placebo, a alteração média na FPG com ONGLYZA foi de -12 mg/dL no subgrupo de pacientes com insuficiência renal moderada, -4 mg/dL no subgrupo de pacientes com insuficiência renal grave, e +44 mg/dL no subgrupo de pacientes com doença renal em estágio terminal. Estes resultados são inconclusivos, pois o estudo não foi devidamente desenhado para demonstrar a eficácia dentro de subgrupos específicos de insuficiência renal.

Os pacientes que completaram o período inicial de 12 semanas do estudo, eram elegíveis a participar de uma extenção de longo prazo do estudo controlado, por 40 semanas. Pacientes que receberam saxagliptina no período inicial de 12 semanas de estudo mantiveram a mesma dose de saxagliptina na extensão de longo prazo. A maioria dos indivíduos (76%) em ambos os grupos de tratamento recebendo insulina ou outros medicamentos anti-hiperglicêmicos não teve nenhuma mudança na dose ou no tipo de medicação durante o período de tratamento de 52 semanas. Para os indivíduos que tiveram uma mudança significativa no tipo e dose de insulina (mais de ± 20%) ou antidiabéticos de uso oral (OAD), os dados de eficácia foram posteriormente excluídos da análise.
O tratamento com saxagliptina 2,5 mg proporcionou uma melhoria sustentada em A1C versus placebo (redução média do valor basal na 52ª semana, de -1,4% para o grupo de saxagliptina e -0,5% para o grupo do placebo).
O perfil de segurança da saxagliptina no período de tratamento a longo prazo foi consistente com o previamente observado na experiência clínica e o observado no período de tratamento de curta duração (12 semanas) deste estudo.
Indicações da Onglyza
Monoterapia e terapia combinada:ONGLYZA é indicado como adjuvante à dieta e à prática de exercícios para melhorar o controle glicêmico em pacientes adultos com diabetes mellitus tipo 2. ONGLYZA não deve ser utilizado para o tratamento de pacientes com diabetes tipo 1 ou para o tratamento da cetoacidose diabética, pois pode não ser eficaz nesses casos.
Contraindicações da Onglyza
ONGLYZA é contraindicado para pacientes com reações alérgicas a qualquer um dos seus componentes; e a pacientes com histórico de hipersensibilidade grave, tais como anafilaxia ou angioedema, a qualquer inibidor de enzima DPP4. (vide “Advertências e Precauções” e “Reações Adversas”.
Modo de Usar e Cuidados de Conservação Depois de Aberto da Onglyza
Os comprimidos devem ser ingeridos sem mastigar com um pouco de liquido. Os comprimidos podem ser ingeridos com ou sem alimentação. Depois de aberto, ONGLYZA deve ser mantido em sua embalagem original, conservado em temperatura ambiente (15º - 30ºC).Posologia da Onglyza
Monoterapia e terapia combinada
A dose recomendada de ONGLYZA é de 2,5mg ou 5 mg em dose única diária como monoterapia ou em terapia combinada. ONGLYZA pode ser tomado com ou sem alimentos. Insuficiência renal
Para pacientes com insuficiência renal leve (clearance de creatinina >50 mL/min), não é necessário ajuste posológico para ONGLYZA.
Para pacientes com insuficiência renal moderada ou grave ou com insuficiência renal terminal que requeiram hemodiálise (clearance de creatinina ≤50 mL/min), a posologia de ONGLYZA é de 2,5 mg em dose única diária. ONGLYZA deve ser administrado logo após a hemodiálise.
ONGLYZA não foi estudado em paciente submetidos a diálise peritoneal.
Como a dose é limitada a 2,5 mg baseada na função renal, é recomendado que seja realizado avaliação de função renal prévia ao início do tratamento com ONGLYZA , e depois periodicamente. O clearance de creatinina pode ser estimado a partir da creatinina sérica utilizando-se a fórmula de Cockcroft-Gault ou a fórmula de modificação da dieta na doença renal. (Vide “Advertências e Precauções” – Uso em pacientes com insuficiência renal).
Fortes inibidores da enzima CYP3A4/5
A dose recomendada de ONGLYZA é de 2,5 mg em dose única diária quando co-administrada com fortes inibidores do citocromo P450 3A4/5 (CYP3A4/5) (por exemplo, cetoconazol, atazanavir, claritromicina, indinavir, itraconazol, nefazodona, nelfinavir, ritonavir, saquinavir e telitromicina).
Insuficiência hepática
Não é necessário ajuste posológico de ONGLYZA para pacientes com insuficiência hepática leve, moderada ou grave.
Pacientes pediátricos
A segurança e eficácia de ONGLYZA em pacientes pediátricos não foram estabelecidas.
Pacientes geriátricos
Não é necessário ajuste posológico para ONGLYZA de acordo com a idade. Pacientes idosos, normalmente, apresentam decréscimo na função renal, portanto deve-se ter precaução na seleção da dose em pacientes idosos baseados na função renal (Vide “Uso geriátrico”).
Conduta necessária caso haja esquecimento de administração
Caso o paciente esqueça de tomar uma dose, ele deverá tomá-la assim que possível, no entanto, se estiver próximo do horário da dose seguinte o paciente deverá esperar por este horário, respeitando sempre o intervalo determinado pela posologia. Nunca devem ser administradas duas doses ao mesmo tempo.
Advertências e Precauções da Onglyza
Uso com medicamentos que podem causar hipoglicemiaSecretatogos de insulina, como as sulfoniluréias, causam hipoglicemia. Por isso, pode ser necessária a administração de uma dose menor de secretagogo de insulina afim de reduzir o risco de hipoglicemia ao utilizá-lo em combinação com ONGLYZA. Reações de hipersensibilidade
Durante a experiência pós-comercialização, as seguintes reações adversas foram relatadas com o uso de saxagliptina: reações de hipersensibilidade graves, incluindo anafilaxia e angioedema. Como estas reações são relatadas voluntariamente por uma população de tamanho incerto, não é possível estimar a sua freqüência com confiança. Se houver suspeita de reação de hipersensibilidade grave à saxagliptina, deve-se descontinuar ONGLYZA, avaliar outras possíveis causas para o evento, e instituir tratamento alternativo para o diabetes (vide “Contraindicações” e “Reações Adversas – Experiência pós comercialização”).
Gravidez e Lactação
Não existem estudos adequados e bem controlados conduzidos em mulheres grávidas. Como os estudos realizados em animais nem sempre são preditivos para as repostas em humanos, ONGLYZA deve ser usado durante a gravidez apenas se claramente necessário, assim como com outros antidiabéticos.
A saxagliptina não demonstrou-se teratogênica em nenhuma dose testada quando administrada em ratas e coelhas grávidas durante o período da organogênese. Ossificação incompleta da pelvis, uma forma de atraso no desenvolvimento, ocorreu nas ratas a uma dose de 240 mg/kg, ou aproximadamente 1503 e 66 vezes a exposição humana à saxagliptina e à seu metabólito principal, respectivamente, na dose máxima recomendada de 5 mg.Toxicidade materna e redução no peso fetal foram observados em doses 7986 e 328 vezes a exposição humana à saxagliptina e à seu metabólito principal, respectivamente. Variações menores no esqueleto de coelhas ocorreram na dose tóxica materna de 200 mg/kg, ou aproximadamente 1432 e 992 vezes a exposição humana máxima recomendada à saxagliptina e à seu metabólito ativo, respectivamente.
A coadministração de saxagliptina e metformina a ratas e coelhas durante o período de organogênese, não foi embrioletal nem teratogênica em ambas as espécies quando testadas a doses gerando exposição sistêmica (AUC) de até 100 e 10 vezes a dose máxima diária recomendada a humanos (5 mg de saxagliptina e 2000 mg de metformina), respectivamente, em ratos; e 249 e 1,1 vez a dose máxima diária recomendada a humanos em coelhos. Em ratos, o desenvolvimento de toxicidade menor se limitou à incidência aumentada de costelas onduladas; a toxicidade associada à mãe se limitou à redução de peso de 11% a 17% ao longo do estudo e reduções ligadas ao consumo de alimento materno. Em coelhos, a coadministração foi pouco tolerada em um subgrupo de mães (12 a 30), resultando em morte, moribundez, ou aborto. Contudo, dentre as mães sobreviventes com ninhadas analisadas, a toxicidade materna estava limitada a reduções marginais do peso corporal ao longo dos dias 21 a 29 do período gestacional; e o desenvolvimento de toxicidade associada nestas ninhadas se limitou à redução de 7% do peso corpóreo fetal, e à baixa incidência de atraso na ossificação do hióide fetal.
A administração de saxagliptina a ratas fêmeas desde o 6º dia de gestação até o 20º dia de amamentação resultou em decréscimo de peso em filhotes machos e fêmeas apenas em doses tóxicas maternas (exposição ≥ 1629 e 53 vezes a exposição humana à saxagliptina e a seu metabólito ativo, respectivamente). Nenhuma toxicidade funcional ou comportamental foi observada na ninhada de ratos que tiveram saxagliptina administrada a qualquer dose.
A saxagliptina atravessa a barreira placentária de ratas prenhas.
A saxagliptina é secretada no leite de ratas lactantes a uma proporção de aproximadamente 1:1 a razão da concentração da droga no plasma. Não se sabe se a saxagliptina é secretada no leite humano. Como muitos fármacos são secretados no leite humano recomenda-se precaução quando ONGLYZA for administrado em mulheres que estejam amamentando.
Categoria de risco: B – Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Uso Pediátrico
A segurança e a eficácia de ONGLYZA em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
Nos 6 estudos duplo-cegos controlados de segurança e eficácia clínica de ONGLYZA , 634 (15,3%), dos 4148 pacientes randomizados tinham idade ≥ a 65 anos, e 59 (1.4%) pacientes tinham idade ≥ 75 anos. Nenhuma diferença em segurança e eficácia foi observada os indivíduos com idade maior ou igual a 65 anos ou entre pacientes mais jovens. Como esta experiência clínica não identificou diferenças entre as respostas de pacientes jovens e idosos, uma maior sensibilidade em alguns pacientes idosos não pode ser descartada. Parte da eliminação da saxagliptina e do seu metabólito ativo é renal. Pacientes idosos, normalmente, apresentam decréscimo na função renal, portanto deve-se ter precaução na seleção da dose em pacientes idosos baseados na função renal destes pacientes (Vide “Posologia” e “Farmacocinética – Populações especiais”)
Efeitos na capacidade de dirigir e operar máquinas
Não foi realizado nenhum estudo para verificar a capacidade de dirigir e de operar máquinas.
Entretanto, deve-se levar em conta que tontura pode ocorrer com o uso de ONGLYZA.
Alterações clinicamente significativas nos sinais vitais não foram observadas em pacientes tratados com ONGLYZA.
Riscos Macrovasculares
Até o momento não há estudos clínicos que estabeleçam evidências conclusivas de redução dos riscos macrovasculares com ONGLYZA ou qualquer outra droga antidiabética.
Interações Medicamentosas
Avaliação in vitro de interações medicamentosas
O metabolismo da saxagliptina é principalmente mediado pela CYP3A4/5.
Em estudos in vitro, nem a saxagliptina nem seu metabólito ativo inibiram as isoenzimas CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1, ou 3A4, nem induziram as enzimas CYP1A2, 2B6, 2C9, ou 3A4. Sendo assim, não se espera que a saxagliptina altere o clearance metabólico de fármacos co-administrados que sejam metabolizados por essas enzimas. A saxagliptina é substrato da P-glicoproteína (Pgp), mas não é um inibidor, nem um indutor significativo da Pglicoproteína (Pgp).
Avaliação in vivo de interações medicamentosas

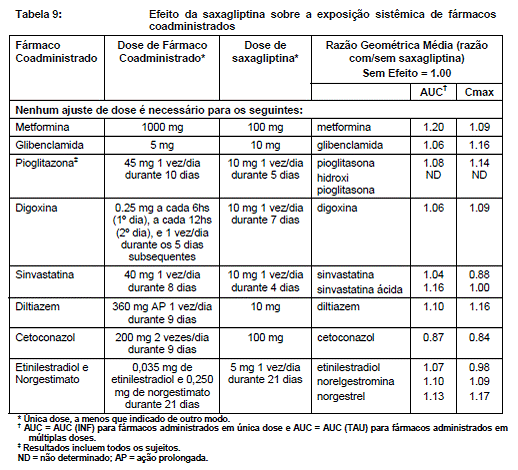
Cetoconazol aumentou significativamente a exposição de saxagliptina. Aumentos significativos e significantes nas concentrações plasmáticas de saxagliptina também ocorreram com outros potentes inibidores da CYP3A4/5 (por exemplo, atazanavir, claritromicina, indinavir, itraconazol, nefazodona, nelfinavir, ritonavir, saquinavir e telitromicina). A dose de ONGLYZA deve ser limitada a 2,5 mg, quando coadministrado com um potente inibidor da CYP3A4/5.
Reações Adversas da Onglyza
Experiência com Estudos Clínicos
Como os ensaios clínicos são conduzidos sob condições muito diversas, as taxas de reações adversas observadas nos ensaios clínicos de um fármaco não podem ser comparadas diretamente com as taxas em ensaios clínicos de um outro fármaco, pois nem sempre refletem as taxas observadas na prática. Monoterapia e terapia em combinação
Em dois estudos de monoterapia placebo-controlados de 24 semanas de duração, os pacientes foram tratados diariamente com ONGLYZA 2,5 mg, ONGLYZA 5 mg e placebo. Três estudos placebo-controlados, de terapia combinada de 24 semanas também foram realizados, um com metformina, um com tiazolidinediona (pioglitazona ou rosiglitazona), e um com glibenclamida. Nestes três estudos, os pacientes foram randomizados para receber ONGLYZA 2,5 mg ou 5 mg diariamente ou placebo em adição à terapia. Um braço de tratamento com saxagliptina 10 mg foi incluído em um dos ensaios em monoterapia, e em combinação com metformina.
Em uma análise pré-especificada dos dados da 24ª semana (indepententemente de resgate glicêmico) dois estudos de monoterapia e dos estudos de terapia combinada com metformina, TZD e glibenclamida, a incidência total de eventos adversos nos pacientes tratados com o ONGLYZA 2,5 e 5 mg foi semelhante ao placebo (72,0% e 72,2% contra 70,6%). A descontinuação da terapia devido a eventos adversos ocorreu 2,2%, 3,3% e 1,8%, dos pacientes recebendo ONGLYZA 2,5 mg, 5 mge placebo, respectivamente. Os eventos adversos mais comuns (relatados por pelo menos 2 pacientes tratados com ONGLYZA 2,5 mg ou pelo menos 2 pacientes tratados com ONGLYZA 5 mg) associados à interrupção da terapêutica incluíram linfopenia (0,1% e 0,5% versus 0%, respectivamente), erupção cutânea (0,2% e 0,3% versus 0,3%), aumento da creatinina sanguínea (0,3% e 0% versus 0%) e aumento da creatinina fosfoquinase (0,1% e 0,2% versus 0%). As reações adversas nesta análise conjunta relatados (independentemente da avaliação do investigador da causalidade) em ≥ 5% dos pacientes tratados com ONGLYZA 5 mg, e mais frequentemente do que nos pacientes tratados com placebo são apresentados na Tabela 10.

Nesta análise associada, as reações adversas que foram notificadas em ≥ 2% dos pacientes tratados com ONGLYZA 2,5 mg ou 5 mg e ≥ 1% mais freqüentemente comparado com o placebo incluem as seguintes: sinusite (2,9% e 2,6% contra 1,6%, respectivamente), dor abdominal (2,4% e 1,7% contra 0,5%), gastroenterite (1,9% e 2,3% contra 0,9%) e vômitos (2,2% e 2,3% contra 1,3%).
No estudo de adição de TZD, a incidência de edema periférico foi maior para ONGLYZA 5 mg versus placebo (8,1% e 4,3%, respectivamente). A incidência de edema periférico para ONGLYZA 2,5 mg foi de 3,1%. Nenhuma das reações adversas relatadas de edema periférico resultou em descontinuação da droga no estudo. Taxas de edema periférico para ONGLYZA 2,5 mg e ONGLYZA 5 mg versus placebo foram de 3,6% e 2% versus 3%, administrado em monoterapia, 2,1% e 2,1% versus 2,2%, dado como terapia adjuvante à metformina e 2,4% e 1,2% versus 2,2%, dado como terapia adjuvante para glibenclamida.
A taxa de incidência de fraturas foi de 1,0 e 0,6 por 100 pacientes-ano, respectivamente, para ONGLYZA (análise combinada de 2,5 mg, 5 mg e 10 mg) e placebo. A taxa de incidência de eventos de fratura em pacientes que receberam ONGLYZA não aumentou ao longo do tempo.
Causalidade não foi estabelecida e estudos não-clínicos não demonstraram efeitos adversos da saxagliptina no osso.
Um evento de trombocitopenia, consistente com um diagnóstico de púrpura trombocitopênica idiopática, foi observado no programa clínico. A relação deste evento para ONGLYZA não é conhecido.
Uso em insuficiência renal
ONGLYZA 2,5 mg foi comparado a placebo em um estudo de 12 semanas feito em pacientes com diabetes tipo 2 e insuficiência renal moderada ou grave, ou doença renal em estágio terminal (ESRD). A incidência de eventos adversos, incluindo eventos adversos graves, e descontinuações devidas a eventos adversos, foi similar entre ONGLYZA e placebo.
Reações adversas associadas com ONGLYZA coadministrada com metformina em pacientes virgens de tratamento para Diabetes Tipo 2
A Tabela 7 mostra as reações adversas notificadas (independentemente da avaliação do investigador da causalidade) em ≥ 5% dos pacientes que participam em um estudo adicional de 24 semanas, ativo-controlado de ONGLYZA coadministrada com metformina no tratamento de pacientes virgens de tratamento.

As reações adversas de hipoglicemia foram baseadas em todos os relatos de hipoglicemia, uma medição de glicose concorrente não era necessária. No estudo com adição de glibenclamida, a incidência global de hipoglicemia relatada foi maior para ONGLYZA 2,5 mg e ONGLYZA 5 mg (13,3% e 14,6%) versus placebo (10,1%). A incidência de hipoglicemia confirmada neste estudo, definida como sintomas de hipoglicemia acompanhada por um valor de glicose no dedo ≤ 50 mg/dL, foi de 2,4% e 0,8% para ONGLYZA 2,5 mg e ONGLYZA 5 mg e 0,7% para o placebo. A incidência de hipoglicemia relatada para ONGLYZA 2,5 mg e ONGLYZA 5 mg versus placebo administrada como monoterapia foi de 4,0% e 5,6% versus 4,1%, respectivamente, 7,8% e 5,8% contra 5% dado como terapia adjuvante à metformina e 4,1% e 2,7% versus 3,8%, dado como terapia adjuvante para TZD. A incidência de hipoglicemia relatada foi de 3,4% em pacientes sem tratamento prévio dado ONGLYZA 5 mg e metformina e 4,0% em pacientes que receberam apenas metformina.
No estudo ativamente controlado, comparando terapia adjuvante com ONGLYZA 5 mg a glipizida em pacientes inadequadamente controlados com metformina isolada, a incidência de hipoglicemia relatada foi 3% (19 eventos em 13 pacientes) com ONGLYZA versus 36,3% (750 eventos em 156 pacientes) com glipizida. Hipoglicemia sintomática confirmada (acompanhada por glicose sanguínea em ponta do dedo <50 mg/dL) não foi relatada em nenhum dos pacientes tratados com ONGLYZA e foi relatada em 35 pacientes tratados com glipizida (8,1%) (p<0,0001).
Durante as 12 semanas de tratamento nos pacientes com insuficiência renal moderada ou grave ou ESDR, a incidência total de hipoglicemia reportada foi 20% entre os pacientes tratados com ONGLYZA 2,5 mg e 22% entre os pacientes tratados com placebo. Quatro pacientes tratados com ONGLYZA (4,7%) e três pacientes tratados com placebo (3,5%) relataram ao menos um episódio de hipoglicemia sintomática confirmada (acompanhada por glicose sanguínea em ponta do dedo <50 mg/dL).
Reações de hipersensibilidade
Eventos relacionados à hipersensibilidade, tais como urticária e edema facial, na análise conjunta dos 5 estudos até à semana 24, foram relatados em 1,5%, 1,5% e 0,4% dos pacientes que receberam ONGLYZA 2,5 mg, ONGLYZA 5 mg e placebo, respectivamente.
Nenhum desses eventos em pacientes que receberam ONGLYZA necessitou de internação ou foi relatado como risco de vida por parte dos investigadores. Um paciente tratado com saxagliptina nesta análise conjunta interrompeu o tratamento devido à urticária generalizada e edema facial.
Infecções
Na base de dados para saxagliptina do estudo clínico não-cego, controlado, até o momento houve 6 relatos (0,12%) de tuberculose entre os 4959 pacientes tratados com saxagliptina (1,1 por 1000 pacientes-anos) comparados a nenhum relato de tuberculose entre os 2868 tratados com o comparador. Dois destes seis casos foram confirmados com testes laboratoriais. Os demais casos tiveram informação limitada ou diagnóstico presumido de tuberculose. Nenhum dos seis casos ocorreu nos Estados Unidos ou Europa Ocidental. Um caso ocorreu no Canadá em um paciente originário da Indonésia que recentemente havia visitado a Indonésia. A duração do tratamento com saxagliptina até o relato de tuberculose variou de 144 a 929 dias.
A contagem de linfócitos pós-tratamento foi consistente dentro da faixa de referência para quatro casos. Um paciente apresentou linfopenia antes do início do tratamento com saxagliptina, a qual permaneceu estável durante o tratamento com saxagliptina.
O paciente final teve uma contagem de linfócitos abaixo do normal isolada, aproximadamente quatro meses antes do relato de tuberculose. Não houve relatos espontâneos de tuberculose associada ao uso de saxagliptina. A causalidade não foi estabelecida e até o momento existem muito poucos casos para se determinar se a tuberculose está relacionada ao uso de saxagliptina.
Até o momento, houve um caso de potencial infecção oportunista na base de dados do estudo não-cego e controlado, em um paciente tratado com saxagliptina que desenvolveu suspeita de septicemia fatal por Salmonella de origem alimentar, após aproximadamente 600 dias de terapia com saxagliptina. Não houve relatos espontâneos de infecções oportunistas associadas ao uso de saxagliptina.
Experiência pós-comercialização
Durante a experiência pós-comercialização, as seguintes reações adversas foram relatadas com o uso de saxagliptina: reações de hipersensibilidade graves, incluindo anafilaxia e angioedema. Como estas reações são relatadas voluntariamente por uma população de tamanho incerto, não é possível estimar a sua frequência com confiança.
Achados Laboratoriais
Contagem absoluta de linfócitos
Houve uma diminuição dose-relacionada média na contagem absoluta de linfócitos observada com ONGLYZA. De uma média basal de linfócitos absoluta de aproximadamente 2200 células/μL, diminuições da média de aproximadamente 100 e 120 células/μL com ONGLYZA 5 mg e 10 mg, respectivamente, em relação ao placebo foram observados em 24 semanas em uma análise conjunta dos cinco estudos clínicos placebo controlados. Efeitos similares foram observados quando ONGLYZA 5 mg foi administrado em combinação inicial com metformina em comparação com metformina. Não houve diferença observada para ONGLYZA 2,5 mg em relação ao placebo. A proporção de pacientes que relataram ter uma contagem de linfócitos ≤ 750 células/μL foi de 0,5%, 1,5%, 1,4% e 0,4% para saxagliptina 2,5 mg, 5 mg, 10 mg, e placebo, respectivamente. Na maioria dos pacientes, não foi observada recorrência devido em a exposição repetida ao ONGLYZA embora alguns pacientes tiveram quedas recorrentes o que levou à interrupção do tratamento com ONGLYZA. A diminuição da contagem de linfócitos não foi associada com reações adversas clinicamente relevantes.
A importância clínica desta diminuição na contagem de linfócitos em relação ao placebo não é conhecida. Quando clinicamente indicada, como em controles de infecção incomum ou prolongada, a contagem de linfócitos deve ser feita. O efeito de ONGLYZA na contagem de linfócitos em pacientes com alterações de linfócitos (por exemplo, o vírus da imunodeficiência humana) é desconhecido.
Plaquetas
ONGLYZA não demonstrou um efeito clinicamente significativo ou consistente na contagem de plaquetas nos seis ensaios clínicos duplo-cegos, controlados de segurança e eficácia.
Superdose da Onglyza
Em um estudo clínico-controlado, ONGLYZA administrado por via oral uma vez ao dia não teve nenhuma reação adversa clínica relacionada à dose ou efeito clinicamente significativo no intervalo QTc ou freqüência cardíaca em doses de até 400 mg por 2 semanas (80 vezes a dose humana recomendada). Caso ocorra um evento de superdosagem, tratamento de suporte apropriado deve ser iniciado conforme o estado clínico do paciente. A saxagliptina e seu metabólito ativo são removidos através de hemodiálise (23% da dose a cada quatro horas).Armazenagem da Onglyza
ONGLYZA deve ser mantido em sua embalagem original, conservado em temperatura ambiente (15º - 30ºC). nº do lote, data de fabricação e data de validade: vide cartucho.
VENDA SOB PRESCRIÇÃO MÉDICA
Fonte: http://www.bulas.med.br/bula/294910/onglyza.htm
Nenhum comentário :
Postar um comentário